Définition, structure de la molécule d'arène.
Arènes- ce sont des composés organiques, des hydrocarbures de nature carbocyclique aromatique, dont les molécules contiennent un ou plusieurs noyaux benzéniques - des groupes cycliques d'atomes de carbone avec une nature spécifique de liaisons - le noyau benzénique, et qui répondent à la formule générale C n H 2n-6.
Le benzène est l'arène le plus simple avec une formule moléculaire C6H6. La formule a été proposée pour la première fois par A. Kekule :
La structure des molécules d'arène.
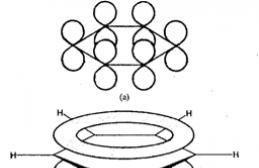
Les 6 atomes de carbone sont présents épisode 2-hybridation. Chaque atome de carbone forme 2 σ -des liaisons avec deux atomes de carbone voisins et un atome d'hydrogène, qui sont dans le même plan. Les angles sont de 120°. Ceux. Tous les atomes de carbone se trouvent dans le même plan et forment un hexagone. Chaque atome possède un atome non hybride R.-l'habitation sur laquelle se trouve l'électron non apparié. Cette orbitale est perpendiculaire au plan, et donc π -le nuage électronique est « étalé » sur tous les atomes de carbone :

Toutes les connexions sont égales. L'énergie de conjugaison est la quantité d'énergie qui doit être dépensée pour détruire un système aromatique.
C'est ce qui détermine les propriétés spécifiques du benzène - la manifestation de l'aromaticité. Ce phénomène a été découvert par Hückel et est appelé règle de Hückel.
2. Isomérie des arènes.
Les arènes peuvent être divisées en 2 groupes :
dérivés du benzène :

Arènes condensées :

La formule générale des arènes est C n H 2n-6.
Les arènes sont caractérisées par une isomérie structurelle, qui s'explique par la disposition mutuelle des substituants dans le cycle. S'il y a 2 substituants dans le cycle, alors ils peuvent être dans 3 positions différentes - ortho (o-), méta (m-), para (p-).
Propriétés physiques
Le benzène et ses homologues les plus proches sont des liquides incolores ayant une odeur spécifique. Les hydrocarbures aromatiques sont plus légers que l'eau et ne s'y dissolvent pas, mais ils sont facilement solubles dans les solvants organiques - alcool, éther, acétone.
Le benzène et ses homologues sont eux-mêmes de bons solvants pour de nombreuses substances organiques. Toutes les arènes brûlent avec une flamme enfumée en raison de la teneur élevée en carbone de leurs molécules.
Les propriétés physiques de certaines arènes sont présentées dans le tableau.
Tableau. Propriétés physiques de certaines arènes
|
Nom |
Formule |
t°.pl., |
t°.b.p., |
|
Benzène |
C6H6 |
5,5 |
80,1 |
|
Toluène (méthylbenzène) |
C6H5CH3 |
95,0 |
110,6 |
|
Éthylbenzène |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Xylène (diméthylbenzène) |
C6H4 (CH3)2 |
||
|
ortho- |
25,18 |
144,41 |
|
|
méta- |
47,87 |
139,10 |
|
|
paire- |
13,26 |
138,35 |
|
|
Propylbenzène |
C 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Cumène (isopropylbenzène) |
C6H5CH(CH3)2 |
96,0 |
152,39 |
|
Styrène (vinylbenzène) |
C6H5CH=CH2 |
30,6 |
145,2 |
Benzène – à faible ébullition ( tballe= 80,1°C), liquide incolore, insoluble dans l'eau
Attention! Benzène – poison, affecte les reins, modifie la formule sanguine (en cas d'exposition prolongée), peut perturber la structure des chromosomes.
La plupart des hydrocarbures aromatiques sont mortels et toxiques.
Préparation des arènes (benzène et ses homologues)
Dans le laboratoire
1. Fusion de sels d'acide benzoïque avec des alcalis solides
C6H5-COONa + NaOH t → C 6 H 6 + Na 2 CO 3
benzoate de sodium
2. Réaction de Wurtz-Fitting: (ici G est halogène)
C6H 5 -G + 2N / A + R.-G →C 6 H 5 - R. + 2 N / Ag
AVEC 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
Dans l'industrie
- isolé du pétrole et du charbon par distillation fractionnée et reformage ;
- à partir de goudron de houille et de gaz de cokerie
1. Déshydrocyclisation des alcanes avec plus de 6 atomes de carbone :
C6H14 t , Kat→C6H6 + 4H2
2. Trimérisation de l'acétylène(pour le benzène uniquement) – R. Zélinski:
3С 2 H2 600°C, Acte. charbon→C6H6
3. Déshydrogénation cyclohexane et ses homologues :
L'académicien soviétique Nikolai Dmitrievich Zelinsky a établi que le benzène est formé à partir du cyclohexane (déshydrogénation des cycloalcanes
C6H12 t, Kat→C6H6 + 3H2

C6H11-CH3 t , Kat→C 6 H 5 -CH 3 + 3H 2
méthylcyclohexantoluène
4. Alkylation du benzène(préparation d'homologues du benzène) – r Friedel-Crafts.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
chloroéthane éthylbenzène

Propriétés chimiques des arènes
je. RÉACTIONS D'OXYDATION
1. Combustion (flamme fumante) :
2C6H6 + 15O2 t→12CO 2 + 6H 2 O + Q
2. Dans des conditions normales, le benzène ne décolore pas l'eau bromée et une solution aqueuse de permanganate de potassium
3. Les homologues du benzène sont oxydés par le permanganate de potassium (décoloration du permanganate de potassium) :
A) dans un environnement acide à l'acide benzoïque
Lorsque les homologues du benzène sont exposés au permanganate de potassium et à d’autres agents oxydants puissants, les chaînes latérales sont oxydées. Quelle que soit la complexité de la chaîne du substituant, elle est détruite, à l'exception de l'atome de carbone a, qui est oxydé en un groupe carboxyle.
Les homologues du benzène avec une chaîne latérale donnent l'acide benzoïque :
Les homologues contenant deux chaînes latérales donnent des acides dibasiques :
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Simplifié :
C6H5-CH3+3O KMnO4→C 6 H 5 COOH + H 2 O
B) dans des sels d'acide neutre et légèrement alcalin à benzoïque
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + KOH + 2MnO 2 + H 2 O
II. RÉACTIONS D'ADDITION (plus dur que les alcènes)
1. Halogénation
C 6 H 6 +3Cl 2 h ν → C6H6Cl6 (hexachlorocyclohexane - hexachlorane)
2. Hydrogénation
C6H6 + 3H2 t , PtouNi→C 6 H 12 (cyclohexane)
3. Polymérisation
III. RÉACTIONS DE SUBSTITUTION – mécanisme ionique (plus léger que les alcanes)
b) homologues du benzène lors d'une irradiation ou d'un chauffage
Les propriétés chimiques des radicaux alkyles sont similaires à celles des alcanes. Les atomes d'hydrogène qu'ils contiennent sont remplacés par des halogènes par un mécanisme de radicaux libres. Par conséquent, en l’absence de catalyseur, lors d’un chauffage ou d’une irradiation UV, une réaction de substitution radicalaire se produit dans la chaîne latérale. L'influence du cycle benzénique sur les substituants alkyle conduit au fait que L'atome d'hydrogène est toujours remplacé par l'atome de carbone directement lié au cycle benzénique (atome de carbone a).
1) C 6 H 5 -CH 3 + Cl 2 h ν → C 6 H 5 -CH 2 -Cl + HCl
c) homologues du benzène en présence d'un catalyseur
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (orta mélange, paire de dérivés) +HCl
2. Nitration (avec acide nitrique)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
nitrobenzène - odeur amandes!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ AVEC H 3 -C 6 H 2 (NON 2) 3 + 3H 2 O2,4,6-trinitrotoluène (tol, TNT)
Application du benzène et de ses homologues
Benzène C 6 H 6 est un bon solvant. Le benzène en tant qu'additif améliore la qualité du carburant. Il sert de matière première pour la production de nombreux composés organiques aromatiques - nitrobenzène C 6 H 5 NO 2 (solvant à partir duquel l'aniline est obtenue), chlorobenzène C 6 H 5 Cl, phénol C 6 H 5 OH, styrène, etc.
Toluène C 6 H 5 –CH 3 – solvant, utilisé dans la production de colorants, médicinaux et explosifs (TNT (TNT) ou 2,4,6-trinitrotoluène TNT).
Xylènes C6H4(CH3)2. Le xylène technique est un mélange de trois isomères ( ortho-, méta- Et paire-xylènes) – utilisé comme solvant et produit de départ pour la synthèse de nombreux composés organiques.
Isopropylbenzène C 6 H 5 –CH(CH 3) 2 est utilisé pour produire du phénol et de l'acétone.
Dérivés chlorés du benzène utilisé pour la protection des plantes. Ainsi, le produit du remplacement des atomes de H dans le benzène par des atomes de chlore est l'hexachlorobenzène C 6 Cl 6 - un fongicide ; il est utilisé pour le traitement à sec des graines de blé et de seigle contre le charbon. Le produit de l'addition de chlore au benzène est l'hexachlorocyclohexane (hexachlorane) C 6 H 6 Cl 6 - un insecticide ; il est utilisé pour lutter contre les insectes nuisibles. Les substances mentionnées appartiennent aux pesticides - moyens chimiques de lutte contre les micro-organismes, les plantes et les animaux.
Styrène C 6 H 5 – CH = CH 2 polymérise très facilement, formant du polystyrène, et lors de la copolymérisation avec du butadiène, des caoutchoucs styrène-butadiène.
EXPÉRIENCES VIDÉO
Hydrocarbures aromatiques (arènes)- les hydrocarbures dont les molécules contiennent un ou plusieurs cycles benzéniques. La composition des arènes à un noyau benzénique correspond à la formule générale C n H 2n-6 .
Dans la molécule de l'arène la plus simple - benzène (C 6 H 6) - les liaisons forment un seul système conjugué (aromatique) délocalisé de liaisons -.
La structure de la molécule de l'arène le plus simple - le benzène - peut être exprimée par des formules développées de différents types :
Isomères et homologues
| g | benzène |
|||||
méthylbenzène (toluène) |
||||||
éthylbenzène |
1,2-diméthylbenzène ( ortho-xylène) |
1,3-diméthylbenzène ( méta-xylène) |
1,4-diméthylbenzène ( paire-xylène) |
|||
propylbenzène |
isopropylbenzène |
1,2,4-tri-méthylbenzène |
1-méthyl-2-éthylbenzène |
1-méthyl-3-éthylbenzène |
1-méthyl-4-éthylbenzène |
|
| isomères | ||||||
Le nom du dérivé substitué du benzène est basé sur le mot « benzène ». Les atomes du cycle benzénique sont numérotés du substituant le plus élevé au plus petit. Exemple : 1-méthyl-2-éthylbenzène, pas 1-éthyl-2-méthylbenzène. Si les substituants sont les mêmes, alors la numérotation est effectuée selon le chemin le plus court. Exemple : 1,3-diméthylbenzène, pas 1,5-diméthylbenzène.
Consoles ortho-, méta-, paire-(du grec orthos - droit, méta - après, à travers, entre, para - contre, proche, passé) au nom de substances organiques (en abrégé : O-, m-, P-) sont utilisés pour indiquer les positions relatives de deux substituants sur un cycle benzénique.
Propriétés physiques du benzène : liquide incolore et insoluble dans l'eau avec une odeur particulière, point de fusion 5,4 o C, point d'ébullition 80,1 o C, densité 0,88 g/cm 3 . Les vapeurs de benzène sont toxiques.
Propriétés chimiques
Le benzène ne décolore pas l’eau bromée et la solution de permanganate de potassium dans des conditions normales.
Obtenir des arènes
Problèmes et tests sur le thème "Thème 3. "Hydrocarbures aromatiques"."
- Hydrocarbures. Polymères - Substances organiques de grade 8 à 9
Leçons : 7 Devoirs : 9 Tests : 1
- - L'homme dans le monde des substances, des matériaux et des réactions chimiques, niveaux 8-9
Leçons : 2 Devoirs : 6 Tests : 1
- Classification des substances - Classes de substances inorganiques de grade 8 à 9
Leçons : 2 Devoirs : 9 Tests : 1
- Treillis cristallins - Structure de la matière grade 8-9
Leçons : 1 Devoirs : 9 Tests : 1
- Composition des solutions - Solutions 8 à 9
Leçons : 3 Devoirs : 8 Tests : 1
Après avoir étudié le sujet, vous devez : comprendre les notions d'hydrocarbures aromatiques, de liaisons aromatiques, connaître la formule générale des arènes, les règles de nomenclature, les types de réactions de substitution (halogénation en présence d'un catalyseur, nitration), d'addition (halogénation à la lumière , hydrogénation).
Vérifiez si vous pouvez effectuer des calculs à l'aide d'équations de réaction et dériver des formules moléculaires de substances basées sur les fractions massiques des éléments, trouver le rendement du produit de réaction et résoudre des problèmes en tenant compte de la fraction massique des impuretés.
Exemple 1. Un hydrocarbure dont la densité de vapeur pour l'hydrogène est de 15 contient 80 % de carbone. Trouvez sa formule moléculaire.
Répondre: C2H6
Exemple 2. A partir de 7,8 g de benzène, on a obtenu 8,61 g de nitrobenzène. Déterminer le rendement du produit de réaction.
Répondre: 70%
Exemple 3. Du carbure de calcium technique pesant 20 g a été traité avec un excès d'eau. Quel volume d'acétylène a été obtenu si la fraction massique d'impuretés dans le carbure technique était de 20 %.
Répondre: 5,6 litres
Une fois que vous êtes sûr de maîtriser tout ce dont vous avez besoin, passez aux tâches du sujet. Nous vous souhaitons du succès.
Lecture recommandée:
- O. S. Gabrielyan et autres Chimie 10e année. M., Outarde, 2002 ;
- L. S. Guzey, R. P. Surovtseva, G. G. Lysova. Chimie 11e année. Outarde, 1999.
- G.G. Lysova. Notes de base et tests en chimie organique. M., Glik Plus SARL, 1999.
Modalités d'obtention. 1. Préparation à partir d'hydrocarbures aliphatiques. Pour obtenir du benzène et ses homologues dans l'industrie, ils utilisent aromatisation les hydrocarbures saturés qui composent le pétrole. Lorsque des alcanes à chaîne droite constitués d'au moins six atomes de carbone sont passés sur du platine ou de l'oxyde de chrome chauffé, une déshydrogénation se produit avec une fermeture simultanée du cycle ( déshydrocyclisation). Dans ce cas, le benzène est obtenu à partir de l'hexane et le toluène est obtenu à partir de l'heptane.
2. Déshydrogénation des cycloalcanes conduit également à des hydrocarbures aromatiques ; Pour ce faire, des vapeurs de cyclohexane et de ses homologues sont passées sur du platine chauffé.

3. Le benzène peut être obtenu à partir de trimérisation de l'acétylène, pour lequel l'acétylène est passé sur du charbon actif à 600 °C.

4. Les homologues du benzène sont obtenus à partir du benzène par sa réaction avec des halogénures d'alkyle en présence d'halogénures d'aluminium (réaction d'alkylation, ou réaction de Friedel-Crafts).

5. Quand la fusion sels d'acides aromatiques avec les alcalis, les arènes sont libérés sous forme gazeuse.
Propriétés chimiques. Le noyau aromatique, qui possède un système mobile d'électrons n, est un objet pratique pour l'attaque par des réactifs électrophiles. Ceci est également facilité par la disposition spatiale du nuage d'électrons a des deux côtés du squelette a plat de la molécule (voir Fig. 23.1, b).
Les réactions les plus typiques des arènes sont celles qui se déroulent selon le mécanisme substitution électrophile, désigné par le symbole S.E.(de l'anglais, substitution, électrophile).
Mécanisme S.E. peut être représenté comme suit :
Dans un premier temps, la particule électrophile X est attirée par le nuage d’électrons n et forme avec lui un complexe n. Deux des six électrons n du cycle forment alors une liaison a entre X et l'un des atomes de carbone. Dans ce cas, l'aromaticité du système est perturbée, puisque dans l'anneau il ne reste que quatre électrons a, répartis entre cinq atomes de carbone (complexe a). Pour maintenir l'aromaticité, le complexe a éjecte un proton et deux électrons de la liaison C-H sont transférés au système d'électrons l.
Les réactions suivantes des hydrocarbures aromatiques se déroulent par le mécanisme de substitution électrophile.
1. Halogénation. Le benzène et ses homologues réagissent avec le chlore ou le brome en présence de catalyseurs - AlCl 3 anhydre, FeCl 3, AlBr 3.

Cette réaction produit un mélange de toluène ortho- et les para-isomères (voir ci-dessous). Le rôle du catalyseur est de polariser la molécule d’halogène neutre pour en former une particule électrophile.
2. Nitration. Le benzène réagit très lentement avec l'acide nitrique concentré, même lorsqu'il est chauffé. Cependant, en agissant mélange nitrant(un mélange d'acides nitrique et sulfurique concentrés), la réaction de nitration se produit assez facilement.
3. Sulfonation. La réaction s'effectue facilement avec l'acide sulfurique « fumant » (oléum).
- 4. Alkylation de Friedel-Crafts- voir ci-dessus pour les méthodes d'obtention des homologues du benzène.
- 5. Alkylation avec des alcènes. Ces réactions sont largement utilisées industriellement pour produire de l'éthylbenzène et de l'isopropylbenzène (cumène). L'alkylation est réalisée en présence d'un catalyseur AlC1 3. Le mécanisme de la réaction est similaire à celui de la réaction précédente.
Toutes les réactions discutées ci-dessus se déroulent selon le mécanisme substitution électrophile S E .
Parallèlement aux réactions de substitution, les hydrocarbures aromatiques peuvent entrer en réactions d'addition, cependant, ces réactions conduisent à la destruction du système aromatique et nécessitent donc de grandes quantités d'énergie et ne se produisent que dans des conditions difficiles.
6. Hydrogénation le benzène est produit par chauffage et haute pression en présence de catalyseurs métalliques (Ni, Pt, Pd). Le benzène est converti en cyclohexane.

Les homologues du benzène lors de l'hydrogénation donnent des dérivés du cyclohexane.
7. Halogénation radicale La destruction du benzène se produit lorsque sa vapeur interagit avec le chlore uniquement sous l'influence d'un rayonnement ultraviolet dur. En même temps, le benzène attache trois molécules et formes de chlore produit solide hexachlorocyclohexane (hexachlorane) C 6 H 6 C1 6 (les atomes d'hydrogène ne sont pas indiqués dans les formules développées).

8. Oxydation par l'oxygène de l'air. En termes de résistance aux agents oxydants, le benzène ressemble aux alcanes : la réaction nécessite des conditions difficiles. Par exemple, l'oxydation du benzène avec l'oxygène de l'air ne se produit qu'avec un fort échauffement (400°C) de sa vapeur dans l'air en présence d'un catalyseur V 2 0 5 ; produits - un mélange d'acide maléique et de son anhydride.

Homologues du benzène. Les propriétés chimiques des homologues du benzène sont différentes de celles du benzène, ce qui est dû à l'influence mutuelle du radical alkyle et du cycle benzénique.
Réactions en chaîne secondaire. Les propriétés chimiques des substituants alkyles sur le cycle benzénique sont similaires à celles des alcanes. Les atomes d'hydrogène qu'ils contiennent sont remplacés par des halogènes par un mécanisme radicalaire (SR). C'est pourquoi en l'absence de catalyseur, lors d'un chauffage ou d'une irradiation UV, une réaction de substitution radicalaire se produit dans la chaîne latérale. Cependant, l'influence du noyau benzénique sur les substituants alkyle conduit au fait que l'hydrogène de l'atome de carbone directement lié au noyau benzénique est d'abord remplacé (un -atome carbone).
Substitution sur le cycle benzénique par mécanisme S.E. Peut être uniquement en présence d'un catalyseur(A1C1 3 ou FeCl 3). La substitution dans le ring se produit à ortho- et en position para par rapport au radical alkyle.

Lorsque le permanganate de potassium et d'autres agents oxydants puissants agissent sur les homologues du benzène, les chaînes latérales sont oxydées. Quelle que soit la complexité de la chaîne du substituant, elle est détruite, à l'exception de l'atome de carbone a, qui est oxydé en un groupe carboxyle.
Les homologues du benzène avec une chaîne latérale donnent acide benzoique.

ARENES (hydrocarbures aromatiques)
Arènes ou hydrocarbures aromatiques – Ce sont des composés dont les molécules contiennent des groupes d'atomes cycliques stables (noyaux de benzène) avec un système fermé de liaisons conjuguées.
Pourquoi « Aromatique » ? Parce que Certaines substances, parmi un certain nombre de substances, ont une odeur agréable. Cependant, de nos jours, le concept « d’aromaticité » a un sens complètement différent.
L'aromaticité d'une molécule signifie sa stabilité accrue, due à la délocalisation des électrons π dans le système cyclique.
Critères d’aromaticité de l’arène :
- Atomes de carbone dans sp 2 -l'état hybride forme un cycle.
- Les atomes de carbone sont disposés dans un seul avion(le cycle a une structure plate).
Un système fermé de connexions conjuguées contient
4n+2électrons π ( n– entier).
La molécule de benzène répond pleinement à ces critères. C6H6.
Concept " cycle benzénique» nécessite un décryptage. Pour ce faire, il est nécessaire de considérer la structure de la molécule de benzène.
DANS
Toutes les liaisons entre les atomes de carbone du benzène sont identiques (il n'y a pas de liaisons doubles ou simples en tant que telles) et ont une longueur de 0,139 nm. Cette valeur est intermédiaire entre la longueur d'une simple liaison dans les alcanes (0,154 nm) et la longueur d'une double liaison dans les alcènes (0,133 nm).L'équivalence des connexions est généralement représentée par un cercle à l'intérieur d'un cycle
La conjugaison circulaire donne un gain d'énergie de 150 kJ/mol. Cette valeur est L'énergie de conjugaison est la quantité d'énergie qui doit être dépensée pour perturber le système aromatique du benzène.
Formule générale: CnH2n-6(n ≥ 6)
Série homologue :
Les homologues du benzène sont des composés formés en remplaçant un ou plusieurs atomes d'hydrogène dans une molécule de benzène par des radicaux hydrocarbonés (R) :
ortho- (Ô-)
substituants sur les atomes de carbone voisins du cycle, c'est-à-dire 1,2- ;
méta- (m-)
substituants via un atome de carbone (1,3-);
paire- (P.-)
substituants sur les côtés opposés du cycle (1,4-).
aryle
C 6H5- (phényle) Et C6H
Les radicaux aromatiques monovalents ont le nom commun " aryle". Parmi ceux-ci, deux sont les plus courants dans la nomenclature des composés organiques :C 6H5- (phényle) Et C6H5CH2- (benzyle). 5CH2- (benzyle).
Isomérie :
de construction:
1) positions des substituants pour di-, trois- Et tétra-benzènes substitués (par exemple, Ô-, m- Et P.-xylènes);
2) squelette carboné dans la chaîne latérale contenant au moins 3 atomes de carbone :
3) isomérie des substituants R, à partir de R = C 2 H 5.
Propriétés chimiques:
Pour les arènes, les réactions se déroulent avec préservation du système aromatique, à savoir, réactions de substitution atomes d'hydrogène associés au cycle.
2. Nitration
Le benzène réagit avec un mélange nitrant (un mélange d'acides nitrique et sulfurique concentrés) :
3. Alkylation
Remplacement d'un atome d'hydrogène dans le cycle benzénique par un groupe alkyle ( alkylation) se produit sous l’influence halogénures d'alkyle ou alcènes en présence de catalyseurs AlCl 3, AlBr 3, FeCl 3.
Substitution dans les alkylbenzènes :
Les homologues du benzène (alkylbenzènes) subissent des réactions de substitution plus activement que le benzène.
Par exemple, lors de la nitration du toluène C6H5CH3 La substitution de non pas un, mais trois atomes d'hydrogène peut se produire avec la formation de 2,4,6-trinitrotoluène :
et facilite la substitution à ces postes.En revanche, sous l'influence du cycle benzénique, le groupe méthyle CH3 dans le toluène, il devient plus actif dans les réactions d'oxydation et de substitution radicalaire que le méthane CH4.
Le toluène, contrairement au méthane, s'oxyde dans des conditions douces (décolore une solution acidifiée de KMnO 4 lorsqu'elle est chauffée) :
Les réactions de substitution radicale se produisent plus facilement que dans les alcanes. chaîne latérale alkylbenzènes :
Ceci s'explique par le fait qu'au stade limite, des radicaux intermédiaires stables se forment facilement (à faible énergie d'activation). Par exemple, dans le cas toluène un radical se forme benzyle Ċ H2-C6H5. Il est plus stable que les radicaux libres alkyles ( Ċ N 3, Ċ H 2 R), car son électron non apparié est délocalisé en raison de l'interaction avec le système d'électrons π du cycle benzénique :
Règles d'orientation
- Les substituants présents sur le cycle benzénique dirigent le groupe nouvellement introduit vers certaines positions, c'est-à-dire avoir un effet d'orientation.
Selon leur action directrice, tous les substituants sont divisés en deux groupes :orienteurs du premier type Et orienteurs du deuxième type.
Orientants du 1er type(ortho-para-orienteurs) dirigent la substitution ultérieure principalement versortho- Et paire- des provisions.
Ceux-ci inclus donneur d'électrons groupes (les effets électroniques des groupes sont indiqués entre parenthèses) :
R( +Je); - OH(+M,-Je); - OU(+M,-Je); - NH2(+M,-Je); - RN 2(+M,-Je) L’effet +M est plus fort que l’effet -I dans ces groupes.
Les orientants du 1er type augmentent la densité électronique dans le cycle benzénique, notamment sur les atomes de carbone deortho- Et paire-positions, ce qui favorise l'interaction de ces atomes particuliers avec des réactifs électrophiles.Les orientants du 1er type, augmentant la densité électronique dans le cycle benzénique, augmentent son activité dans les réactions de substitution électrophile par rapport au benzène non substitué.
Une place particulière parmi les orientants du 1er type est occupée par les halogènes, qui présententattracteur d'électrons propriétés:
-F (+M<–I ), -Cl (+M<–I ), -Br (+M<–I ).
Être ortho-para-orientants, ils ralentissent la substitution électrophile. Raison - forte -JE-l'effet des atomes d'halogène électronégatifs, qui réduisent la densité électronique dans l'anneau.
Orientants du 2ème type ( méta-orienteurs) substitution ultérieure directe principalement à méta-position.
Ceux-ci inclus attracteur d'électrons groupes:
-NON 2 (–M, –Je); -COOH (–M, –Je); -CH=O (–M, –Je); -SO3H (-JE); -NH3+ (-JE); -CCI 3 (-JE).
Les orientants du 2ème type réduisent la densité électronique dans le cycle benzénique, notamment dans ortho- Et paire- des provisions. Par conséquent, l’électrophile attaque les atomes de carbone non pas dans ces positions, mais dans méta-position où la densité électronique est légèrement plus élevée.
Exemple:
Ainsi, la facilité de substitution électrophile des composés (donnés à titre d'exemple) diminue dans l'ordre :
toluène C 6 H 5 CH Contrairement au benzène, ses homologues s’oxydent assez facilement.